Se dice que el agua es el "disolvente universal" porque disuelve a más tipos de sustancias y en cantidades mayores que cualquier otro disolvente. El carácter polar del agua la convierte en un disolvente excelente de los materiales polares y de los iónicos, de los que se dice que son hidrofílicos.
Las sustancias que al disolverse en agua dan lugar a la formación de iones se les llama electrolitos y pueden ser débiles o fuertes, según estén parcial o totalmente ionizados o disociados en el medio. Los electrolitos fuertes son buenos conductores de la corriente eléctrica. En este grupo se encuentran ácidos y bases fuertes y sus sales. NaCl, H2SO4, KOH se disocian en sus iones correspondientes Na+, Cl-, 2H+, SO42-, K+ y OH-.
Los electrolitos débiles son los que se disocian parcialmente y existen como una mezcla en equilibrio de iones y moléculas por lo que conducen poco la corriente eléctrica. En este grupo se encuentran ácidos y bases débiles y sus sales. Ejemplos: NaHCO3 (bicarbonato de sodio), CH3-COOH (ácido acético), CH3-COONa (acetato de sodio).
Los no electrolitos son aquellos que no se ionizan, solamente se disuelven como moléculas. Sus soluciones no conducen la corriente eléctrica. Algunos ejemplos son la glucosa y la urea.
El comportamiento del agua frente a sustancias no polares, apolares o hidrofóbicas es totalmente diferente a lo descrito con anterioridad. Las moléculas no polares, como los lípidos, no se disuelven en agua por no formar puentes de hidrógeno. Otras sustancias, como los fosfolípidos, que poseen grupos polares y no polares al mismo tiempo (conocidas como moléculas anfipáticas), se agrupan alrededor de los grupos polares y forman puentes de hidrógeno con el agua, mientras que los grupos no polares establecen interacciones hidrofóbicas entre sí. Esta doble solubilidad de las moléculas anfipáticas les permite formar micelas coloidales muy estables que determinan la estructura y propiedades biológicas de proteínas, ácidos nucleicos, membranas y otros componentes celulares.
Esta propiedad también es utilizada por el organismo para transportar los lípidos en el plasma formando micelas denominadas quilomicrones, en donde los fosfolípidos que tienen la mayor parte de su molécula con carga determinada por la presencia del grupo fosfato, se comportan como una molécula con una cabeza polar y una gran cola no polar, de tal forma que al mezclarse en agua estas moléculas, tienden a asociarse formando una monocapa y al agregar más fosfolípidos se forma una bicapa lipídica.
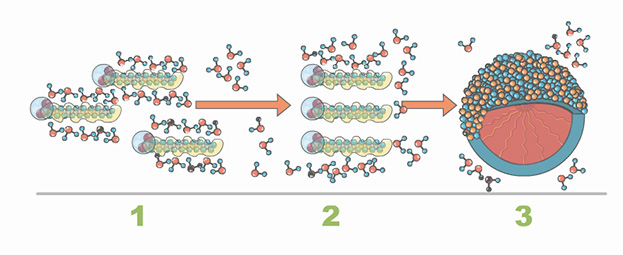
Esta formación de micelas es muy importante en el transporte de lípidos, ya que los fosfolípidos pueden englobar aquellos lípidos que son totalmente no polares para ser absorbidos y transportados en el organismo.
La presencia de partículas en solución, modifica las propiedades características del agua y da origen a lo que se conoce como propiedades coligativas de las soluciones, éstas dependen del número de partículas en la solución y no de su naturaleza.

