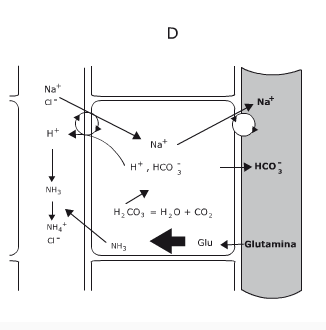
Disociación del agua y pH
Debido a la alta polaridad de las moléculas de agua, entre ellas se forman puentes de hidrógeno y como consecuencia, una molécula de agua tiene la capacidad de ceder un protón a la molécula vecina y esto ocasiona que la molécula que cedió su protón quede con una carga neta negativa y la molécula de agua que lo acepta quede con una carga positiva. Esto indica que el agua se ioniza, ya que actúa como un ácido al donar protones (H+) llamados también iones hidrógeno y como una base al aceptarlos, según la teoría de Brönsted y Lowry.
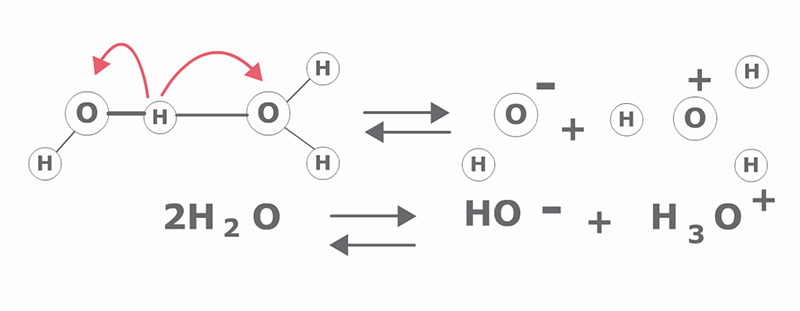
Así, el agua puede encontrarse en dos especies iónicas: el hidronio (H3O+) una molécula de agua que acepta un protón y que funcionaría como ácido, y el hidroxilo OH–, que es la especie que queda al ceder la molécula de agua su protón, y que funciona como una base, ya que puede aceptar protones. Para facilitar la expresión de la ionización del agua se simplifica así:

El ion hidronio (H3O+ ) se simplifica como H+ (ion hidrógeno, protón o hidrogenión). Para el agua pura, la concentración de ambos iones es de 1 x 10 –7.
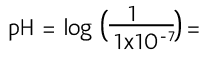
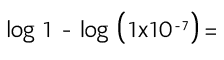
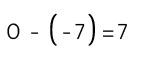
¿Sabías que la escala de pH se define a partir del agua?
En esta escala se dice que cuando la concentración del ion hidronio [H+] es mayor de 1x10–7 o su pH es menor de 7 estamos hablando de sustancias ácidas y que cuando la concentración es menor de 1x10–7 y pH mayores a 7, estamos hablando de soluciones básicas. Para comprender la relación entre los valores numéricos en que se expresa la concentración del ion hidronio H+ con su correspondiente valor de pH, observa la siguiente tabla:
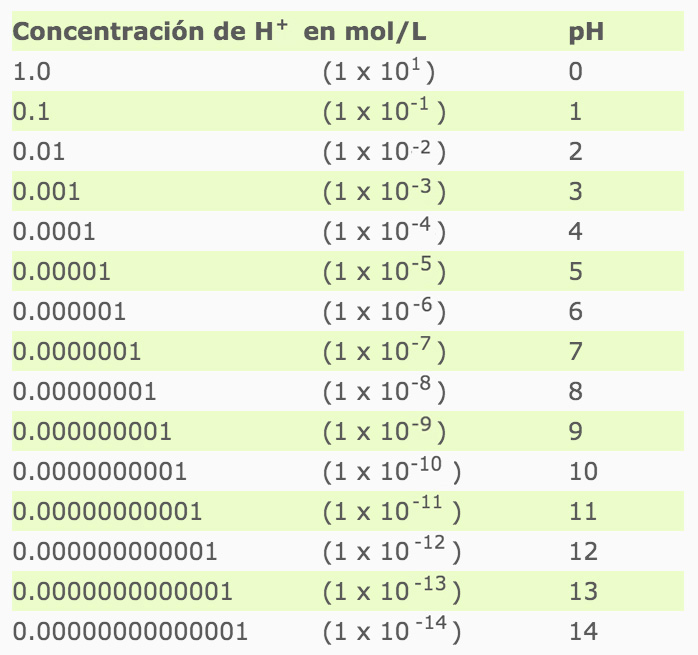
Por ejemplo, cuando la concentración de iones [H+] en solución acuosa es de 1.0 M, el valor del pH es 0, ya que el logaritmo de 1 es 0, y cuando la concentración de H+ es 1x 10–14, el pH es de 14. Se dice que una sustancia es neutra cuando el pH = 7 o cuando la concentración de iones hidrógeno [H+] es de 1 x 10–7.
Todos sabemos que para indicar la acidez de una solución el intervalo de pH va del 0 al 6.9, mientras que el intervalo correspondiente a una solución alcalina o básica va de 7.1 a 14.
Para completar la siguiente tabla, utiliza una calculadora. Ahora, podrás calcular el pH de los líquidos que se te proponen dada la concentración del ión hidrógeno y viceversa.
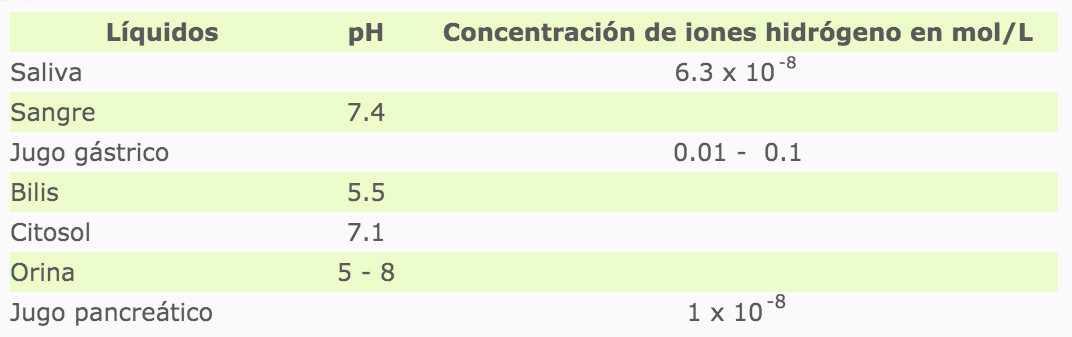
Como la escala de pH es una escala logarítmica con base 10, el pH se obtiene:
- Marcando en la calculadora la concentración de H+ (1x10-5), acuérdate que es 1 exponente -5.
- Enseguida se saca el logaritmo (debe salir -5)
- Posteriormente se le cambia el signo (queda 5)
Para el procedimiento contrario:
- Se escribe en la calculadora el pH (5)
- Se le cambia el signo (-5)
- Se saca el antilogaritmo, comúnmente son las teclas shift seguida de log ó 10x (debe salir 1x10-5 ó 0.00001)
La concentración normal de iones hidrógeno en los líquidos corporales es muy pequeña, sin embargo, la concentración de estos iones es uno de los factores reguladores más importantes de la mayor parte de las reacciones metabólicas de las células, pues determinan la conformación de las enzimas que llevan a cabo esas reacciones. Para que tengas una idea más clara, los límites compatibles con la vida del ser humano están entre 7.0 y 7.8. Cambios por arriba o por debajo de estos límites generan alteraciones graves del funcionamiento global del organismo.