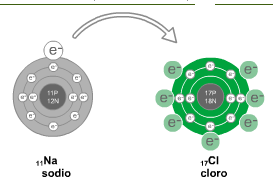
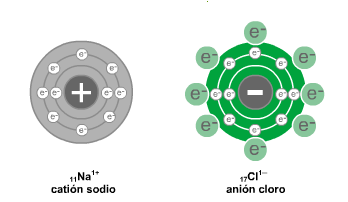
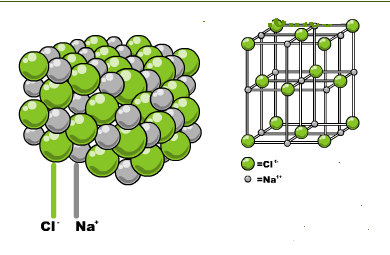
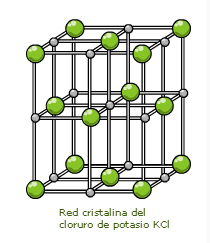
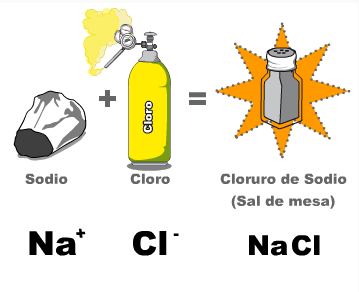
Hasta el día de hoy se conocen 118 elementos y están clasificados en la tabla periódica. Obviamente hay más sustancias en la naturaleza que los 118 elementos puros y se debe a que los átomos de diferentes elementos pueden reaccionar unos con otros para formar nuevas sustancias denominadas compuestos. Un compuesto se forma cuando dos o más átomos se enlazan químicamente. El compuesto que resulta de este enlace es química y físicamente único y diferente de sus átomos originarios. Por ejemplo, el elemento sodio es un metal sólido que reacciona violentamente en presencia de agua y el cloro es un no metal en estado gaseoso de color amarillo verdoso y es venenoso. Al combinarse estas dos sustancias en las proporciones adecuadas forman un compuesto que diariamente tenemos en nuestra mesa: sal (cloruro de sodio).
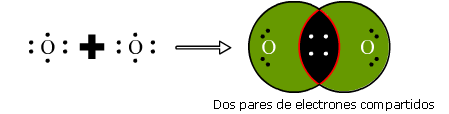
En la Tierra la mayor parte de los elementos existen como átomos enlazados. Rara vez se presentan como átomos aislados. Por ejemplo, el oxígeno, el nitrógeno, el hidrógeno y loshalógenos se encuentran como moléculas diatómicas. El azufre amarillo y el fósforo blanco existen como moléculas cuyas fórmulas son S8 y P4, respectivamente.
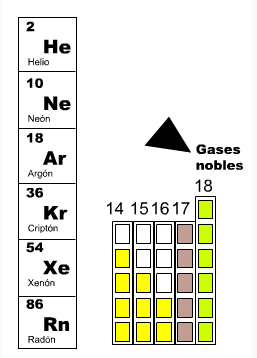
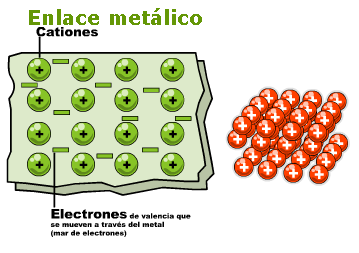
El carbono, en forma de diamante y grafito, así como el fósforo rojo, son macromoléculas compuestas por muchos átomos enlazados en una red. La mayoría de los elementos metálicos, tales como el aluminio, el cobre y el potasio, están formados por innumerables átomos enlazados entre sí a excepción de los gases nobles como el helio y el argón, que existen como átomos sin enlazar. A temperaturas superiores a 5000 °C, la mayor parte de la materia está en un estado gaseoso monoatómico.
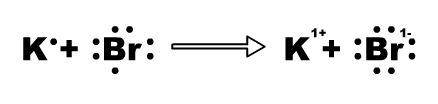
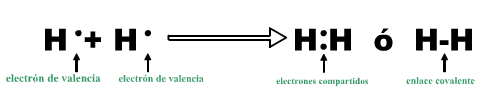
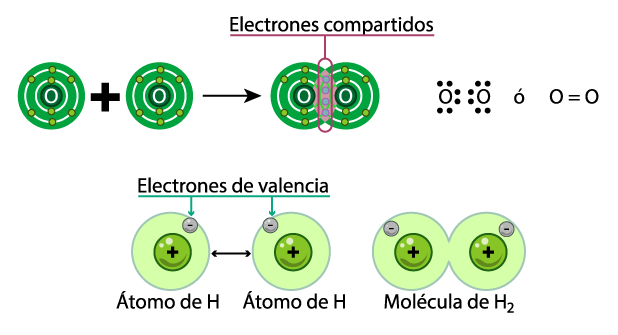
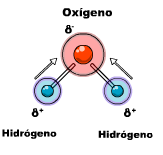
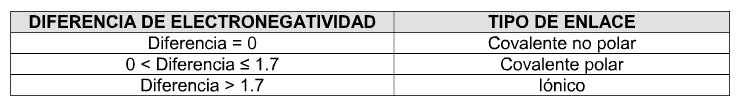
Un enlace químico es la unión entre los átomos de un compuesto. Esta unión se origina en la estructura electrónica de los mismos. La actividad química de los elementos radica en su tendencia a adquirir, mediante su unión con otros átomos, la configuración electrónica de gas noble que es muy estable (ocho electrones en el nivel más alejado del núcleo, salvo el helio, que solo tiene dos).