Las principales alteraciones del equilibrio ácido-base
Cuanto se genera una alteración del equilibrio ácido-base, el primer sistema que entra a funcionar es la amortiguación y en seguida la compensación, éstos se realizan a través de los pulmones; debido a que el aparato respiratorio está diseñado para funcionar a corto plazo en la compensación de las alteraciones ácido-base pues una de sus funciones es la eliminación del CO2 con el agua espirada, con lo cual se elimina también el H2CO3 generado y en consecuencia la liberación de protones al disociarse este ácido.
A nivel de tejidos pulmonares, se llevan a cabo las siguientes reacciones:
CO2 + H2O  H2CO3
H2CO3  H+ + CO3-
H+ + CO3-
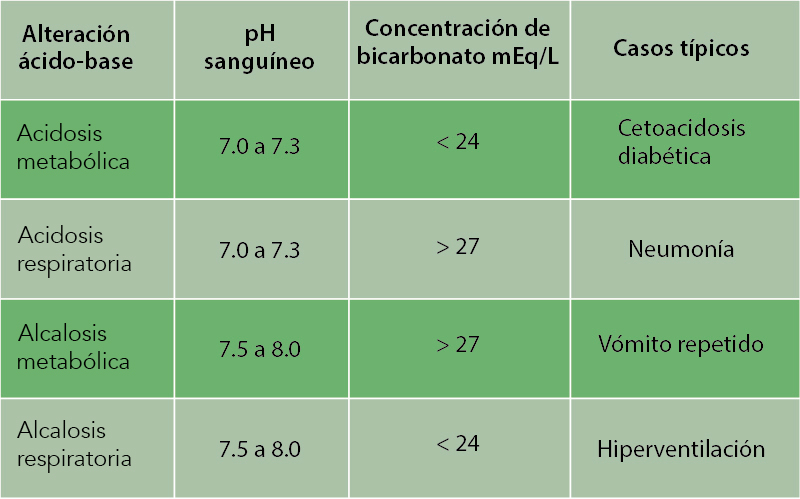
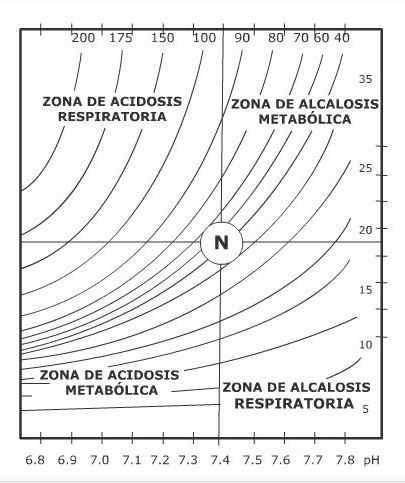
Veamos un ejemplo en el caso de la acidosis. Durante este proceso se generan protones por el aumento de los ácidos líquidos (conocidos como fijos) no volátiles que se excretan por el riñón, así, al aumentar el ácido láctico, el beta-hidroxibutírico y el acetoacético, disminuye la concentración de bicarbonato, es decir, se genera una acidosis metabólica.
El aumento en la concentración sanguínea de protones va a ser detectado por las terminaciones nerviosas de las grandes arterias, en el arco aórtico y en el seno carotídeo (glomus carotídeo) de donde parten a través de los nervios los impulsos que llegan al centro respiratorio bulvar estimulándolo para aumentar la frecuencia y la profundidad de las respiraciones (respiración de Kussmaul). Esto acarrea un aumento en la eliminación pulmonar del CO2 con el cual se da origen a una alcalosis respiratoria que compensa la acidosis metabólica. Los pacientes con acidosis metabólica grave tienen ese tipo de respiración como un fenómeno compensatorio y un signo clínico importante.
Un ejemplo cotidiano de este mismo fenómeno sería cuando se lleva a cabo un ejercicio muscular intenso y prolongado. Tu respiración se acelera para eliminar el CO2 producido por el metabolismo muscular y para compensar la acidosis generada por el ácido láctico de la contracción anaerobia, como se revisará más adelante.
El riñón también contribuye a la regulación de la concentración de H+ a través del incremento o disminución de la concentración de bicarbonato. Como consecuencia de esto, el pH de la orina varía en función de las necesidades corporales de excreción del ácido o base. La participación del riñón en la regulación del pH se debe a que puede eliminar selectivamente los iones que componen el espacio plasmático; es decir, elimina o desecha: Na+, Cl-, K+, HCO3-, H+, H2PO4-, etcétera, logrando con ello restablecer el equilibrio iónico del espacio extracelular y compensar las variaciones de pH que se hayan generado.
Un ejemplo de lo anterior, se refleja en la sobreproducción de protones (acidosis) en donde el riñón elimina protones bajo la forma de fosfato ácido (H2PO4-) y de cloruro de amonio (NH4+Cl-). En el caso de una disminución de protones (alcalosis) se elimina bicarbonato (HCO3-).
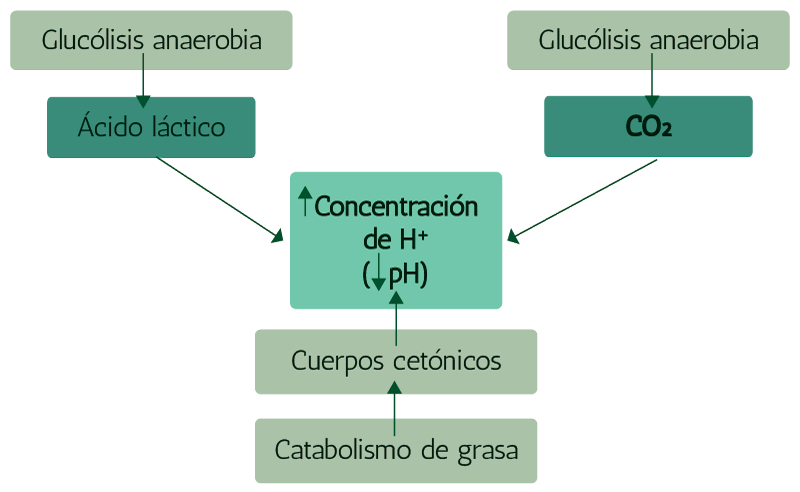
En el caso del ejercicio de resistencia (aerobio), aumenta el metabolismo, principalmente en las células musculares con lo cual se genera una carga ácida mayor de lo habitual como se observa en el siguiente esquema.
Lo anterior se observa porque hay un aumento de la eliminación del CO2, lo que ocurre al aumentar la frecuencia y la profundidad de la respiración como mecanismo compensatorio a la acidosis provocada por el aumento del CO2. Al mismo tiempo, el ejercicio intenso acarrea una aceleración del metabolismo oxidativo para proveer la energía (ATP) necesaria para la contracción muscular. Este aumento en la demanda de ATP trae como consecuencia que al aumentar el catabolismo de la grasa, se generen los cuerpos cetónicos: acetoacetato y beta-hidroxibutirato que son moléculas de carácter ácido y en consecuencia se incrementa la presencia de ácidos fijos en la sangre (cetosis del ejercicio).
Así, al aumentar los cuerpos cetónicos, se incrementan los aniones y disminuye el espacio bicarbonato con lo cual se integran los aspectos definitorios de la acidosis metabólica: disminución del pH sanguíneo con disminución del bicarbonato.
En el caso del ejercicio de alta intensidad (anaeróbico), la gran demanda de energía puede satisfacerse solamente con la aceleración de la glucólisis anaerobia cuyo producto final es el lactato. Debido a que la producción neta de ATP en la glucólisis anaerobia es mucho menor que en la aerobia la cantidad de glucosa procesada en la vía tiene que ser muy alta y por lo tanto también lo será el lactato producido.
El lactato es una molécula ácida que desplaza el equilibrio hacia la acidosis pues al aumentar la carga de ácido se expande el espacio de "ácidos orgánicos" en el ionograma, con lo cual la columna de aniones fijos sube y disminuye el espacio bicarbonato. Se configura así un cuadro de acidosis metabólica: disminución del pH sanguíneo con disminución del bicarbonato, pero a diferencia de la cetosis del ejercicio lo que aumenta en este caso es el lactato por lo cual se llama acidosis láctica.


 H2CO3
H2CO3