Recordarás que cuando hacemos pasar la luz a través de un prisma óptico se produce el efecto llamado dispersión, que consiste en la separación de las distintas longitudes de onda que forman el rayo incidente. La luz blanca produce, al descomponerla, lo que llamamos un espectro continuo.

El espectro continuo contiene el conjunto de colores que corresponde a la gama de longitudes de onda que la integran. Sin embargo, los elementos químicos en estado gaseoso y sometidos a temperaturas elevadas producen espectros discontinuos en los que se aprecia un conjunto de líneas que corresponden a emisiones de sólo algunas longitudes de onda. El conjunto de líneas espectrales que se obtiene para un elemento es siempre el mismo, incluso si el elemento forma parte de un compuesto. Cada elemento produce su propio espectro, diferente al de cualquier otro elemento; esto significa que cada elemento tiene su propia firma espectral, a lo que también se conoce como su huella digital. ¿Te imaginas la gran utilidad de este hallazgo?
Los espectros atómicos son característicos para cada elemento químico y pueden ser tanto de emisión como de absorción. Sirven para identificar cada uno de los elementos de la tabla periódica por simple visualización y análisis de la posición de las líneas de absorción o emisión en su espectro. Si observas los espectros de emisión y absorción notarás que las líneas de colores del espectro de emisión coinciden con las líneas negras del espectro de absorción.
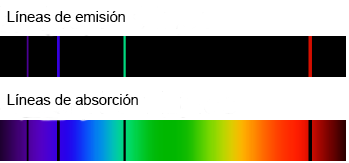
Todos los elementos que se encuentran en la tabla periódica tienen sus espectros de emisión y de absorción. Así es como podemos discriminar uno de otro. Para los astrónomos son de gran utilidad, ya que si quieren conocer la composición de estrellas o de cuerpos muy alejados, con la luz que emiten pueden deducir que sustancias pueden encontrar en sitios tan lejanos.
Te invitamos a visitar la siguiente página para que puedas ver los espectros atómicos de todos los elementos y puedas comparar sus espectros de emisión y de absorción. Por ejemplo, podrás ver que el sodio presenta dos líneas intensas en la región amarilla a 589 nm y 589.6 nm en su espectro de emisión, que si lo comparas con su espectro de absorción, vas a observar dos líneas negras a esa misma longitud de onda.
Espectros de emisión y absorción open_in_newDespués de esta visita y de realizar el ejercicio de comparación, esperamos que te haya quedado clara la diferencia entre un espectro de emisión y uno de absorción.




