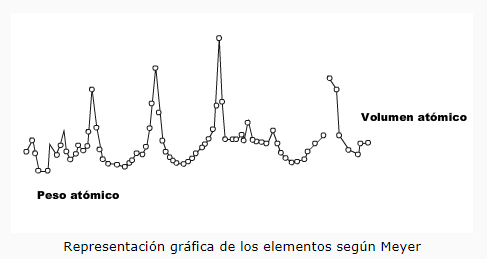
Te has preguntado por qué para estudiar los elementos químicos siempre lo primero que nos enseñan es la tabla periódica. En la década de 1860 se conocían más de 60 elementos, y saber las propiedades de todos ellos era imposible para cualquier químico, pero muy importante para poder realizar su trabajo. Por ello, los científicos de la época comenzaron a idear la forma de ordenar a los elementos de acuerdo a sus propiedades para hacer más fácil su recuerdo.
En 1829, Johann Döbereiner, químico alemán, se percató que algunos elementos debían guardar cierto orden. Seleccionó algunos elementos químicos en grupos de tres, observando que las masas atómicas de dichos elementos son aproximadamente las mismas, como el caso de hierro, cobalto y níquel (55.85, 58.93 y 58.69, respectivamente). En el grupo de calcio, estroncio y bario observó que formaban compuestos de composición similar y con propiedades similares (estado de agregación sólido), en las que la masa atómica del elemento intermedio estroncio era aproximadamente la media aritmética de los extremos.

Fuente: Wikimedia
Lo mismo ocurría con el azufre, selenio y telurio (la masa atómica del selenio es aproximadamente la media entre las masas atómicas del azufre y el telurio) y con los elementos cloro, bromo y iodo (en este caso, el elemento intermedio era el bromo). Es lo que se conoce como tríadas de Döbereiner. Sin embargo, las investigaciones llevadas a cabo presentaban la dificultad de que no siempre se disponía de valores exactos y se hacía difícil la búsqueda de regularidades. Por ello, las ideas de Döbereiner cayeron en el olvido, aunque muchos químicos intentaron buscar una relación entre las propiedades de los elementos.