La mayoría de las propiedades físicas y químicas del agua son realmente excepcionales, comparadas con algunas otras sustancias o compuestos químicos en los que está presente el hidrógeno. Observa los datos de la siguiente tabla, los compuestos que se mencionan pueden compararse con el agua por sus propiedades como solventes o porque, contienen elementos como el azufre, que pertenecen al mismo grupo de la tabla periódica que el oxígeno y forman hidruros (como el H2S).
| Compuesto | Constante dieléctrica a 20 ºC | Punto de fusión (ºC) | Punto de ebullición (ºC) | Calor de vaporización (Cal/g) | Capacidad calórica (Cal/gºC) | Calor de fusión (Cal/g) |
|---|---|---|---|---|---|---|
| H2O | 78.5 | 0 | 100 | 540 | 1.000 | 80 |
| Etanol | 24 | -114 | 78 | 204 | 0.581 | 24.9 |
| Metanol | 33 | -98 | 65 | 263 | 0.600 | 22 |
| Acetona | 20.7 | -95 | 56 | 125 | 0.528 | 23 |
| NH3 | 16.9 | -78 | -33 | 327 | 1.120 | 84 |
| H2S | 9.3 | -83 | -60 | 132 | - | 16.7 |
| HF | - | -92 | 19 | 360 | - | 54.7 |
¿A qué se deben estas diferencias numéricas?
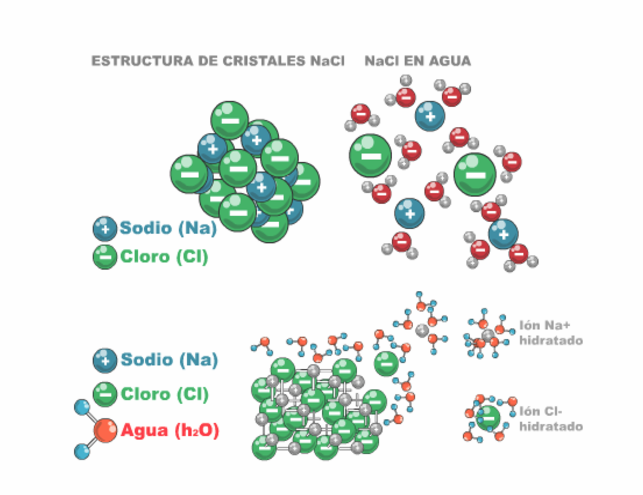
Como puede verse en la tabla, el agua tiene prácticamente los valores más altos para las propiedades que se revisan. Esto se debe a que la molécula del agua está muy polarizada, es decir, que hay una distribución desigual de los electrones en ella. El lado de la molécula donde se encuentra el oxígeno es relativamente rica en electrones, en tanto que del otro lado los núcleos de los hidrógenos están relativamente desnudos y forman una zona de carga parcial positiva como se ilustra en la siguiente figura.
La representación anterior, modelo compacto, no muestra la geometría real de la molécula; sin embargo es importante destacar que la estructura de la molécula de agua está dada por la unión de dos átomos de hidrógeno con un átomo de oxígeno que se mantienen unidos por enlaces covalentes; que el agua es una molécula polar y en consecuencia, forma enlaces por puentes de hidrógeno con otras moléculas de agua.
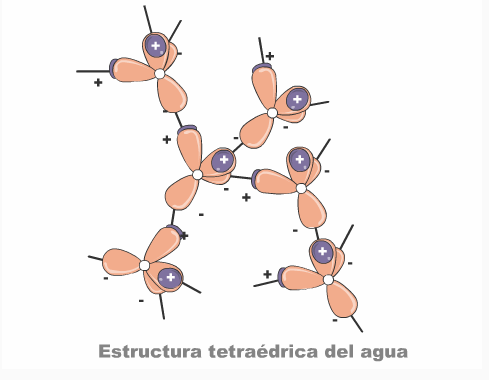
El carácter dipolar de la molécula de agua favorece la interacción entre ellas mismas y con otras moléculas mediante atracciones de naturaleza electrostática. La polaridad que la molécula de agua presenta le permite a una molécula interaccionar hasta con 4 moléculas vecinas, estableciendo interacciones denominadas puentes de hidrógeno.
La estructura molecular del agua (H2O) puede representarse de dos maneras distintas, una de ellas es el modelo compacto y otra el modelo de esferas y barras, también conocido como modelo orbital.
El modelo orbital (o representación tridimensional), ofrece una descripción más precisa de la estructura tetraédrica (de la forma) de la molécula del agua, la cual es producto de la configuración electrónica de los dos átomos de H (1s1) unidos por medio de dos enlaces covalentes a dos de los cuatro orbitales híbridos sp3 del oxígeno. Veamos la siguiente representación:
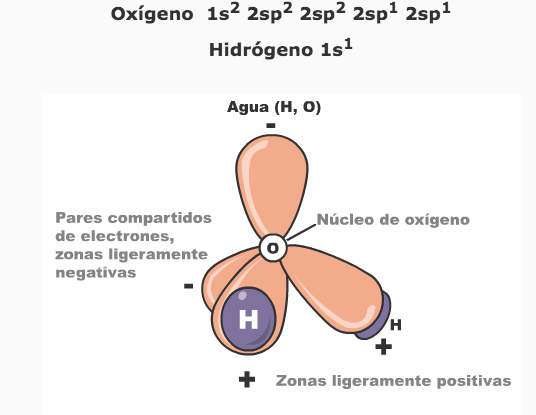
En esta estructura, dos de los cuatro orbitales híbridos sp3 del oxígeno están ocupados por dos pares de electrones (los electrones no compartidos que vimos en el modelo de Bohr). Cada uno de los otros dos orbitales que están ocupados con sólo un electrón se llena con la adición de un electrón del hidrógeno. Así la molécula de agua es vista como un tetraedro con el átomo de oxígeno en su centro, los dos enlaces con el hidrógeno están dirigidos hacia dos vértices del tetraedro, en tanto que los electrones no compartidos del oxígeno ocupan los dos vértices restantes.
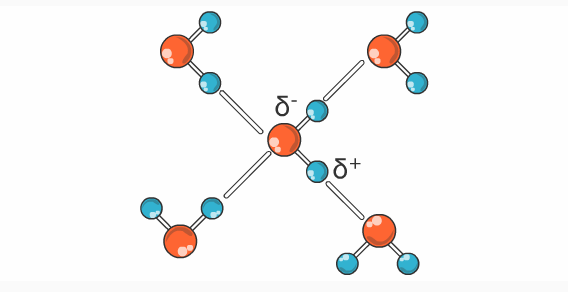
Como consecuencia de este arreglo geométrico y del valor alto de electronegatividad que tiene el átomo de oxígeno, la molécula de agua está fuertemente polarizada, por lo que el oxígeno tiende a atraer con mayor fuerza a los electrones de los dos átomos de hidrógeno, produciendo una carga parcial positiva alrededor del protón, es decir el hidrógeno y dos cargas parciales negativas en el oxígeno.
Ahora veamos la función que cumplen las propiedades del agua en nuestro cuerpo.