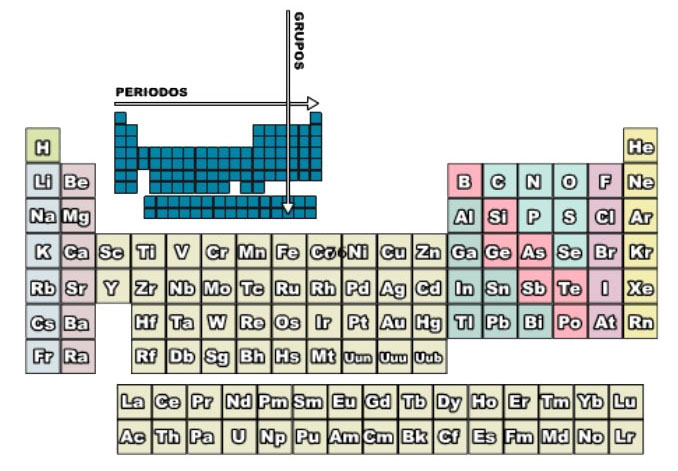
El sistema periódico actual es una forma de ordenar los elementos en grupos y en períodos, de manera que en los grupos se colocan los elementos de propiedades análogas, mientras que en los períodos se colocan los elementos que aumentan en una unidad el número atómico del elemento precedente. Fue apenas en el siglo XX que se descubrió que las propiedades de los elementos no son función periódica de las masas atómicas, sino que varían periódicamente con sus números atómicos.
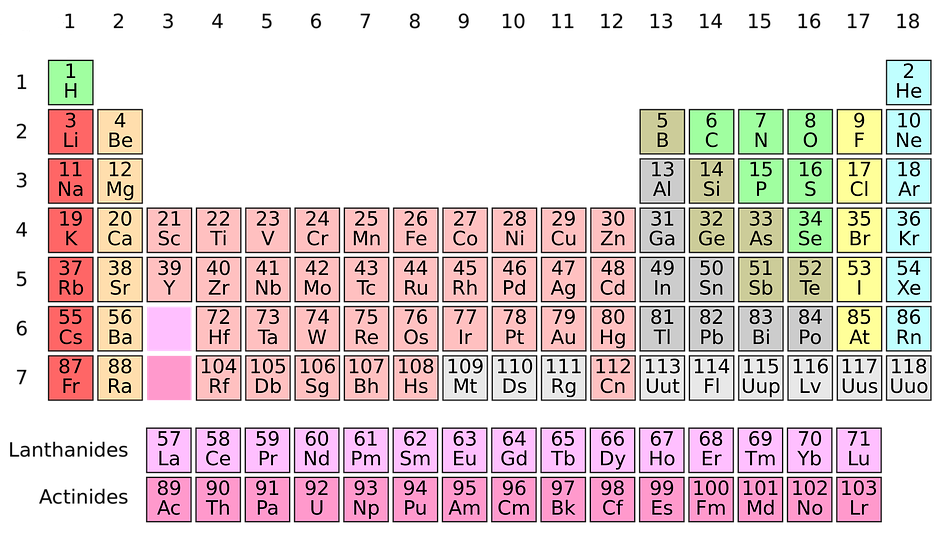
La tabla periódica se organiza en siete filas horizontales, que se llaman periodos, y 18 columnas verticales, que reciben el nombre de grupos. Además, por facilidad de representación, aparecen dos filas horizontales fuera de la tabla que corresponden a elementos que deberían ir en los periodos sexto y séptimo, después del tercer elemento del periodo.

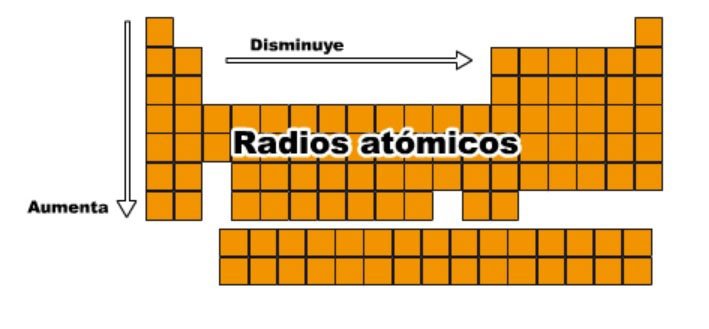
Da click para agrandar
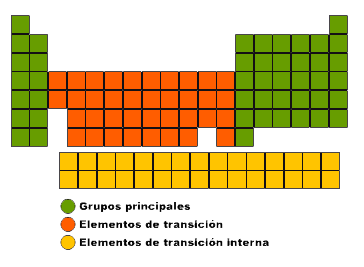
Los grupos con mayor número de elementos son: 1, 2, 13, 14, 15, 16, 17 y 18. Se conocen como grupos principales. Los grupos del 3 al 12 están formados por los llamados elementos de transición, y los elementos que aparecen aparte se conocen como elementos de transición interna. Los elementos de la primera fila de elementos de transición interna se denominan lantánidos, ya que continúan a partir del elemento lantánido con número atómico 57. Los de la segunda fila son actínidos y continúan después del elemento actinio, con número atómico 89.
Observa la siguiente estructura en la imagen:
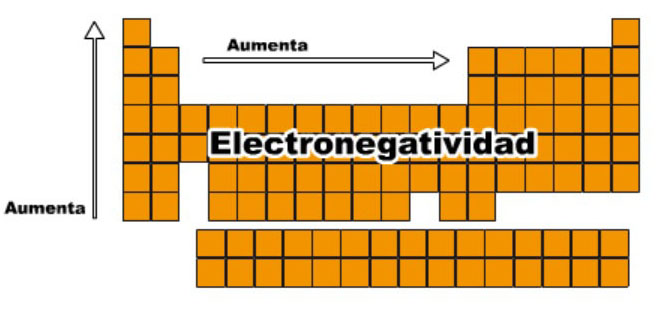
Da click para agrandar
El número del grupo al que pertenece un elemento coincide con sus electrones de valencia (de dos dígitos, corresponde al segundo dígito).

Da click para agrandar
Una de las ventajas de la tabla periódica es que permite predecir las propiedades de los elementos con sólo ver su posición dentro de ella. Además permite realizar comparaciones entre diferentes propiedades de los elementos, a las cuales se les conoce como propiedades periódicas.