Sabemos que la energía pasa de ser potencial a cinética o al revés; sin embargo, en la mayoría de los problemas de la vida cotidiana una parte de la energía (a veces toda) se disipa, es decir, que se convierte en formas de energía que no se pueden aprovechar.
En el caso de un carro circulando, su energía sería cinética. De acuerdo con la masa del carro y la velocida que alcanzará, la energía cinética, $E_c$, inicial será muy grande, pero al frenar y detenerse totalmente su velocidad final, será cero, por lo tanto su energía cinética final también será nula $E_c=0$.

Para deducir qué es lo que pasó con toda la energía cinética del principio consideremos que necesitamos aplicar los frenos para detenernos. Así, una parte muy pequeña de la energía se convierte en ruido, pero la mayoría se transforma en energía calorífica o térmica y calienta las balatas o los discos de los frenos.
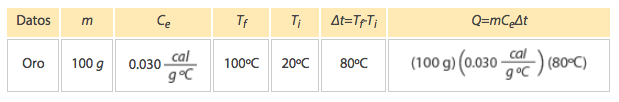
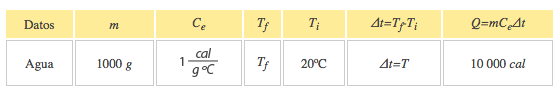
El primero que hizo una prueba para medir la relación entre la energía mecánica y el calor fue el físico inglés James Prescott Joule, quien puso cierta cantidad de agua en un recipiente aislado térmicamente, dentro del agua colocó unas pequeñas palas y les enredó una cuerda de la cual colgaba un objeto de peso conocido. Cuando caía el objeto las palas giraban y agitaban el agua dentro del recipiente.
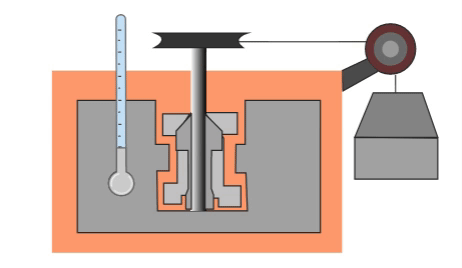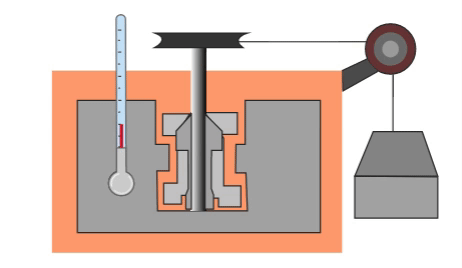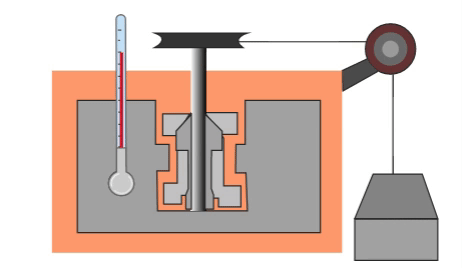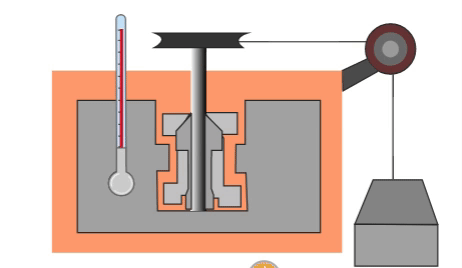
El objeto colgante estaba a cierta altura al principio, por lo cual tenía energía potencial almacenada que se podía calcular. Al caer, toda la energía potencial se convertía en energía calorífica que calentaba el agua. Por su trabajo, se estableció una nueva unidad de medida que, en su honor, tomó el nombre de Joule, y que actualmente sirve no solamente para medir energía, sino también trabajo y calor.
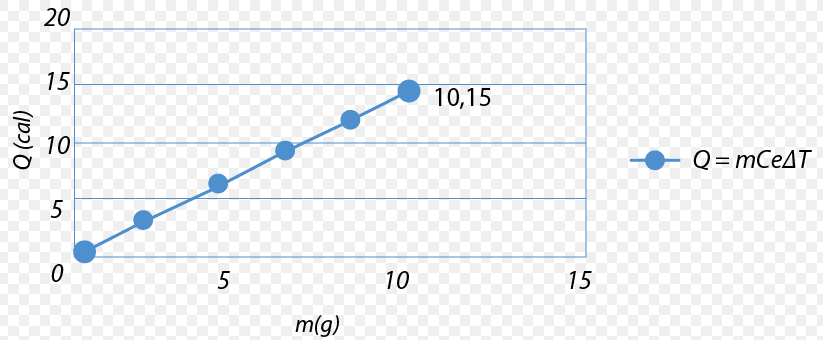
James Joule midió la energía calorífica que ganaba el agua con el movimiento de las palas y estableció que:
$$1 cal= 4.18 J$$
( 1 caloría = 4.18 Joules )
A este valor se le conoce como equivalente mecánico del calor y corresponde a una caloría.